近日���,同濟大學醫(yī)學院上海東方醫(yī)院腫瘤科化學科學與工程學院石碩教授在納米平臺用于腫瘤聯(lián)合治療的研究方面取得了新的進展��。相關(guān)研究成果已發(fā)表在國際知名期刊《ACS Applied Materials & Interfaces》(IF=9.229、一區(qū)top期刊)上����。

△ 圖1
國際知名期刊《ACS Applied Materials & Interfaces》
先前已有實驗將化學動力療法 (CDT) 和光動力療法 (PDT) 整合到一個納米平臺中,此種方案可以產(chǎn)生更多的活性氧 (ROS) 用于腫瘤治療�����。但是�����,如何在腫瘤區(qū)域選擇性地產(chǎn)生足夠的活性氧仍是一個未解決的難點����。
在本研究中,研究人員設(shè)計了一種用于腫瘤聯(lián)合治療的的 pH/ROS 響應(yīng)納米平臺�����。酸性微環(huán)境可誘導多柔比星 (DOX) 釋放����,從而通過DNA 損傷誘導腫瘤細胞凋亡���。除此之外����,DOX 還可以促進 H2O2的產(chǎn)生����,為CDT提供充足的反應(yīng)原料。
并且���,研究人員注意到����,位于核心的上轉(zhuǎn)換納米粒子可以將980nm的光轉(zhuǎn)化為紅光和綠光�����,分別用于激活二氫卟吩E6(chlorin e6)(Ce6)產(chǎn)生單線態(tài)氧并實現(xiàn)上轉(zhuǎn)換發(fā)光成像����。然后�,ROS反應(yīng)性連接子雙-(烷硫基)烯烴被1O2裂解,釋放芬頓計劃(Fenton reagent) (Fe2+)�,實現(xiàn)CDT����。
綜上所述�,F(xiàn)e2+ @UCM-BBD 通過協(xié)同化學/光動力學/化學動力學聯(lián)合治療,能夠具備按需釋放治療試劑的能力�、優(yōu)異的生物相容性和顯著的腫瘤抑制能力。
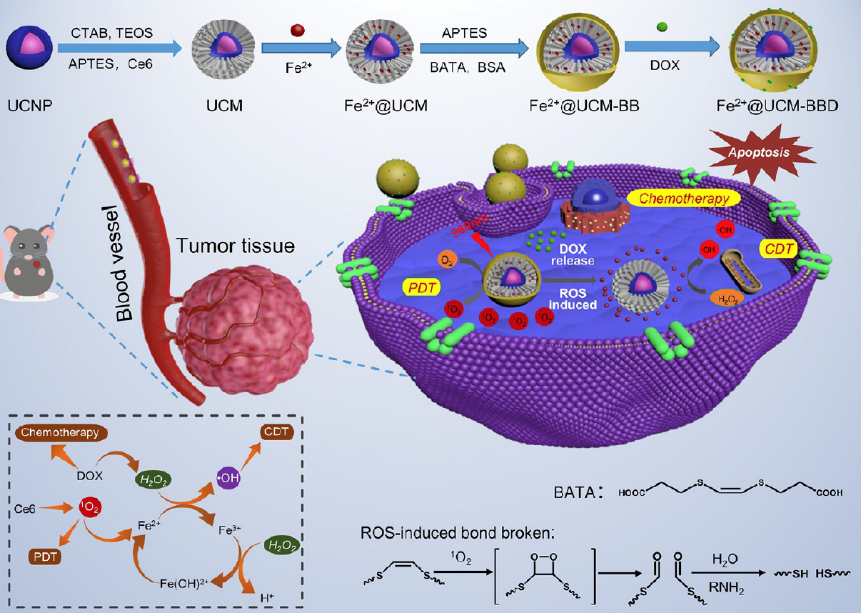
在本研究中��,石碩教授課題組開發(fā)了一種基于UCNP的納米平臺,負載DOX�、Fenton(Fe2+)和Ce6,將其命名為Fe2+@UCM-BBD�,通過pH/ROS刺激誘導治療藥物特異性釋放��,實現(xiàn)腫瘤特異性PDT/CDT化療協(xié)同治療��。
△ 圖2
Fe2+@UCM-BBD 的制備過程和 Fe2+@UCM-BBD 用于化學動力學/光動力學聯(lián)合腫瘤治療示意圖
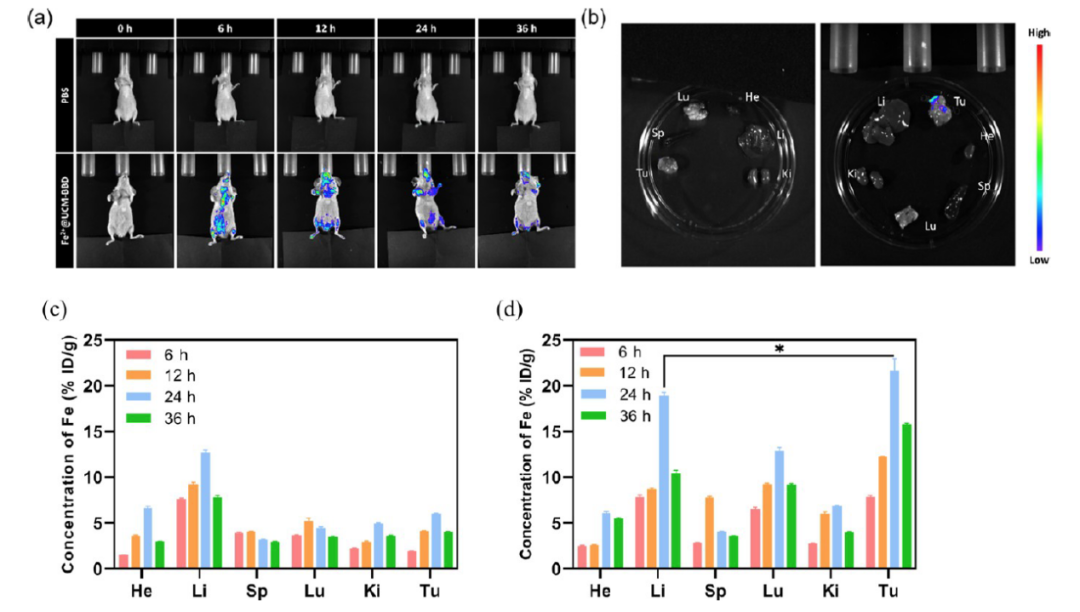
△ 圖3 體內(nèi)熒光成像
(a) 對照組和Fe2+@UCM-BBD組靜脈給藥后在不同時間點的分布圖
(b) 在36小時處死荷瘤裸鼠后切除的主要器官和腫瘤的熒光成像
(c) PBS組和(d) Fe2+@UCM-BBD組主要組織和腫瘤中Fe的生物分布